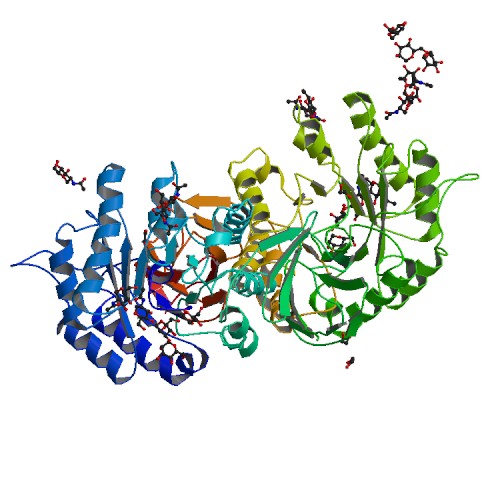
Die Morbus Fabry Krankheit ist eine X-Chromosomale, erbliche und seltene lysosomale Speicherkrankeit. Die Fabry Krankheit ist benannt nach dem Deutschen Arzt Johannes Fabry, der zusammen mit William Anderson die Krankheit im Jahre 1898 erstmals beschrieben hat. Sie ist in der Regel angeboren. Bei den Patienten fehlt es an einem Enzym namens Alpha-Galactosidase-A. Dadurch lagern sich immer häufiger Globotriaosylceramide in den Blutgefäßwänden des gesamten Körpers ab. Dieses führt zu einer verminderten Durchblutung und schließlich zur verminderten Gewebe- und Zellnahrung. [1]
Morbus Fabry: Prävalenz und Symptome
Die Symptome der Morbus Fabry Krankheit sind schwer erkennbar, da der Verlauf und die Intensität unterschiedlich sind. Zudem kann es viele verschiedene oder nur einzelne Organe betreffen. Die Prävalenz beträgt 1: 40.000, laut neuen Studien soll die Häufigkeit dieser Krankheit in Wirklichkeit noch höher sein.[2] Betroffen sind vor allem Männer. Behandelbar ist diese Krankheit mit einer lebenslangen Enzymersatztherapie per i.v. Gabe. Die Lebenserwartung bei unbehandelten Männern Beträgt im Durchschnitt 50 und bei Frauen 70 Jahre. Die Hauptursachen für den Tod sind neben Nierenversagen, Schädigung des Herzens und die verminderte Blutversogung.
Neues Orphan Drug: Pegunigalsidase alfa
Eine neues Orphan Drug von Protalix Bio Therapeutics, einem israelischen Biotechnologie Unternehmen soll die Behandlung noch besser und sicherer machen. Partner von Protalix ist das italienische Pharmaunternehmen Chiesi Farmaceutici Die Pegunigalsidase alfa ist eine stabilere, chemisch modifizierte Form des rekombinanten alpha-Galactosidase-A-Proteins. Zudem soll sie eine höhere Kreislaufhalbwertszeit haben. Dadurch soll die Infusionsgabe bei einigen Patientengruppen mit Morbus Fabry auf einmal pro Monat gesenkt werden.
Studien zeigen bessere Wirksamkeit bei der Morbus Fabry Krankheit
Die Pegunigalsidase alfa, bzw. PRX 102, ist sehr weit und bereits in Phase III (BRIGHT Clinical Trial). Die Rekrutierung ist laut dem Unternehmen abgeschlossen.[3] Laut Ergebnissen früherer Kohortenstudien zeigen eine erhöhte Sicherheit und Wirksamkeit gegenüber bereits vorhandenen Therapiemöglichkeiten bei Morbus Fabry. Ein Patient von insgesamt neunzehn Patienten zog sich nach einer schwerwiegenden Nebenwirkung aus der Studie zurück. [4] Die klinische Wirksamkeit von Pegunigalsidase alfa soll in drei klinischen Phase-3-Studien weiter untersucht werden.
Protalix und Chiesi planen für 2020 ein beschleunigtes Zulassungsverfahren
Protalix und Chiesi gaben kürzlich bekannt, dass sie im ersten Quartal 2020 ein beschleunigtes Zulassungsverfahren BLA (Biologics License, für für Pegunigalsidase alfa zur Behandlung von Morbus Fabry stellen wollen[5]. Dies soll aufgrund der bisherigen Studienlage der Phasen I/II und derzeit laufenden BRIDGE-Studie (Phase III) und der gegenseitigen Korrespondenz mit der FDA erfolgen. Im Falle einer Genehmigung kann Protalix auf eine Meilensteinzahlung von Chiesi hoffen. Moshe Manor CEO und Präsident von Protalix ist in jeder Hinsicht optimistisch, dass das Pegunigalsidase alfa beschleunigt zulassen wird.
Lesen Sie auch Frauen Viagra
Quellen – Morbus Fabry Krankheit
- Pegunigalsidase alfa (PRX-102) for the treatment of Fabry Disease Link zugegriffen am 07 Juli 2019
- D. Marsden, H. Levy: Newborn screening of lysosomal storage disorders. In: Clinical chemistry. Band 56, Nummer 7, Juli 2010, S. 1071–1079, doi:10.1373/clinchem.2009.141622. PMID 20489136. (Review). Link
- Protalix BioTherapeutics Completes Enrollment in the Phase III BRIGHT Clinical Trial of pegunigalsidase alfa (PRX 102) for the Treatment of Fabry Disease. Link zugegriffen am 07 Juli 2019
- Schiffmann R1, Goker-Alpan O2, Holida M3, Giraldo P4, Barisoni L5, Colvin RB6, Jennette CJ7, Maegawa G8, Boyadjiev SA9, Gonzalez D10, Nicholls K11, Tuffaha A12, Atta MG13, Rup B14, Charney MR15, Paz A16, Szlaifer M16, Alon S16, Brill-Almon E16, Chertkoff R16, Hughes D17. Pegunigalsidase alfa, a novel PEGylated enzyme replacement therapy for Fabry disease, provides sustained plasma concentrations and favorable pharmacodynamics: A 1-year Phase 1/2 clinical trial. J Inherit Metab Dis. 2019 May;42(3):534-544. Link https://www.ncbi.nlm.nih.gov/pubmed/30834538
- Protalix BioTherapeutics and Chiesi Farmaceutici S.p.A to Apply for Accelerated Approval of pegunigalsidase alfa for the Treatment of Fabry Disease in the United States. Link zugegriffen am 07 Juli 2019
 Blog über Arzneimittel & Gesundheit Neues aus der Pharmawelt. Nachrichtne über neue Arzneimittel, Pharmazie und Gesundheit
Blog über Arzneimittel & Gesundheit Neues aus der Pharmawelt. Nachrichtne über neue Arzneimittel, Pharmazie und Gesundheit



2 Kommentare
Pingback: Elfabrio (Pegunigalsidase alfa) von Protalix: Positive Meinung von der CHMP - Welt der Pharmazie - Blog über Arzneimittel & Gesundheit
Pingback: Elfabrio (Pegunigalsidase alfa) bei Morbus Fabry zugelassen - Welt der Pharmazie - Blog über Arzneimittel & Gesundheit